Was heißt Evidenz in der Medizin?
Die Medizin ist eine Handlungswissenschaft.
Sie fragt stets nach der besten Handlung bzw. Maßnahme für den Patienten. „Handeln“ meint in der Medizin einen sehr weiten Bereich. Er umfasst im weitesten Sinne alle Handlungen, die zur Erkennung, zur Behandlung, wenn möglich Heilung und zur Vorbeugung von Krankheiten des Menschen unternommen werden.
So geht es in der Medizin primär nicht um Erkenntnis, sondern um Handlungen, die erkrankten Menschen Heilung oder Linderung verschaffen sollen. Die Medizin ist somit eine Handlungswissenschaft, eine „Wissenschaften vom Handeln“. Im Gegensatz zu den Grundlagen- bzw. Erkenntniswissenschaften muss sie als „angewandte Wissenschaft“ vornehmlich den Anforderungen der Praxis genügen. Sie muss ein systematisches und relevantes Wissen herstellen mit dem Ziel, Handlungskompetenz zu erzeugen und wirksame Problemlösungsstrategien abzuleiten.
Die Medizin basiert auf empirischer Forschung.
Sie strebt durch einen systematischen Prozess eine Verwissenschaftlichung dieses empirischen Wissens an. In den letzten 25-30 Jahren hat sich als Systematik einer rationalen Verwissenschaftlichung die Methodik der Evidenzbasierten Medizin (EbM) durchgesetzt. Der Begriff wurde von Gordon Guyatt aus der Arbeitsgruppe um David Sackett von der McMaster Universität aus Hamilton, Kanada, in die Medizin eingeführt.
Ursprünglich war mit Evidenz der bewusste, ausdrückliche und wohlüberlegte Gebrauch der jeweils besten Informationen für Entscheidungen in der Versorgung eines individuellen Patienten gemeint. Daraus entwickelte sich die Definition von Medizin als einer Handlungswissenschaft, die Evidenz aus Studien, Daten und der Erfahrung schafft, um ihren Nutzen retrospektiv zu überprüfen und die diese Evidenz nutzt, um zukünftige Fälle (besser) lösen zu können.
Die evidenzbasierte Medizin - drei gleichberechtigte Säulen
Die evidenzbasierte Medizin stützt sich auf drei Säulen (siehe Abb. 1)1,2:
- die ärztliche Erfahrung (individuelle klinische Expertise oder interne Evidenz),
- die individuellen Werte und Wünsche der PatientInnen (Patientenpräferenz) und
- den aktuellen Stand der klinischen Forschung (bester verfügbarer externer Evidenz).
Unter individueller klinischer Expertise (ärztlicher Erfahrung) werden das Können und die Urteilskraft verstanden, welche ÄrztInnen durch ihre Ausbildung und klinische Praxis und die damit verbundene Erfahrung erwerben.
Unter bester verfügbarer externer Evidenz (Studien/ wissenschaftliche Erfahrung) „…wird die klinisch relevante Forschung, oft medizinische Grundlagenforschung, aber insbesondere patientenorientierte Forschung zur Genauigkeit diagnostischer Verfahren (einschließlich der körperlichen Untersuchung), zur Aussagekraft prognostischer Faktoren und zur Wirksamkeit und Sicherheit therapeutischer, rehabilitativer und präventiver Maßnahmen verstanden.“1
Von großer Bedeutung ist darüber hinaus die Berücksichtigung der dritten Säule der EbM, der Präferenzen und Rechte der PatientInnen (Patientenpräferenz) für die klinische Entscheidungsfindung im Zuge der Behandlung.
David Sackett erkannte früh, dass die einseitige Anwendung von Studienwissen zu einer ‚Tyrannei der externen Evidenz’ führt (Abb. 2)2, da ohne Berücksichtigung der beiden anderen Säulen reine Faktenanwendung die Medizin unmenschlich macht, da die Präferenzen des Patienten und die Fähigkeiten des Arztes unberücksichtigt bleiben.
Die wissenschaftliche Absicherung der drei Säulen
Jede der drei Säulen braucht ihre eigene wissenschaftliche Absicherung und damit auch entsprechend der unterschiedlichen Fragestellungen geeignete Studiendesigns (siehe Abb. 3).
Gilt für die externe Evidenz der randomisiert kontrollierte Versuch ( engl. randomized controlled trial; RCT) als Goldstandard und wird dieser mit der höchsten Stufe der externen Evidenz bewertet, so gilt er dennoch nur als ‚Proof of Principle’. Das heißt, der RCT ist geeignet, eine Wirkung zu belegen. Ob eine Wirkung wesentlich ist, hängt vom gewählten Prüfziel einer Studie ab.
Wird z.B. bei Bluthochdruck ein Medikament auf Blutdrucksenkung (den sog. Surrogatmarker) mittels RCT getestet, so wird damit eine Wirkung belegt. Damit ist jedoch noch keine Wirksamkeit nachgewiesen, da diese erst durch eine Studie belegt wäre, die zeigt, dass die Komplikationen der Bluthochdruckerkrankung durch das Medikament besser beherrschbar bzw. die Überlebenszeit (sog. Outcomeparameter) verbessert wäre. Die betroffene Patientengruppe also einen Vorteil von der Behandlung hätte.
Gilt für die Absicherung der externen Evidenz der RCT als Goldstandard, um eine Wirkung zu belegen und damit das höchste Evidenzlevel zu generieren, so bedürfen die beiden anderen Evidenzsäulen anderer Studiendesigns und haben entsprechend ihrer Fragestellung einen eigenen Goldstandard für die höchste Evidenz. Die Evidenzhierarchisierung der externen Evidenzsäule darf keinesfalls auf die anderen Evidenzsäulen übertragen werden.
So stellen Versorgungsforschungsstudien mittels Kohortenvergleichen heute (z.B. für die Krankenkassen) eine viel bessere Aussage zu Wirksamkeiten unter Alltagsbedingungen für die verschiedenen Therapieoptionen dar. Denn: der RCT schließt in der Regel nur sehr spezielle Patienten in die Studie ein, das bedeutet, dass nicht selten eine Patientenpopulation untersucht wird, die nur einen kleinen Teil der realen Patientenpopulation in der Bevölkerung repräsentiert (sog. Artefaktforschung).
Jede Fragestellung benötigt daher ihr eigenes optimales Studiendesign. Die einfache externe Evidenzhierarchisierungspyramide besitzt folglich keine Allgemeingültigkeit und entspricht nicht mehr dem (wissenschaftlichen) Standard.
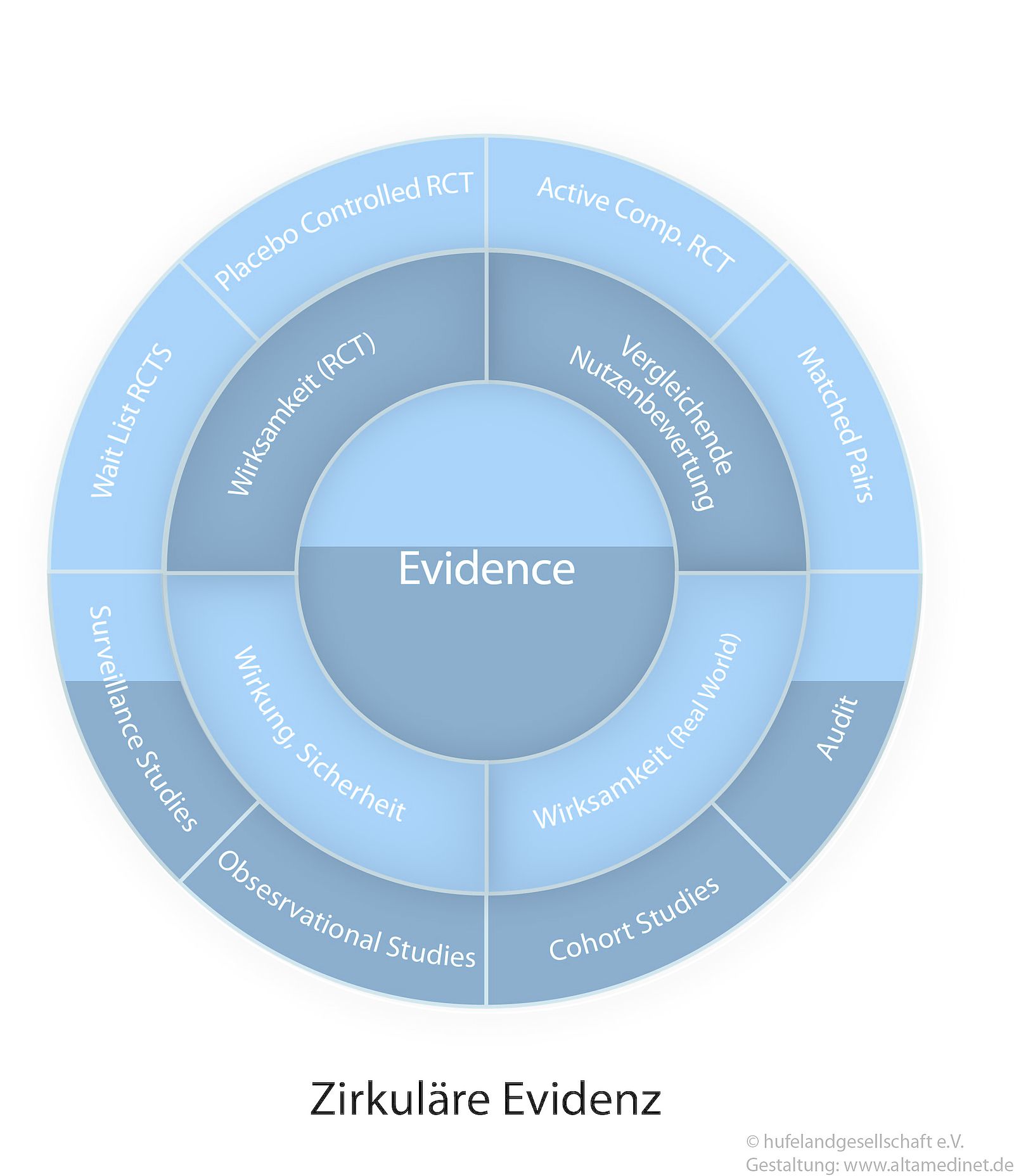
Der neue Standard: Die zirkuläre Evidenz
Aus der einstmals hierarchischen Struktur der Evidenz ist heute konsequenterweise eine zirkuläre Evidenz geworden, die je nach Fragestellung das Studiendesign hierarchisiert (siehe Abb. 5)5. Die sog. CONSORT Kriterien (The Consolidated Standards for Reporting of Trials) legen dabei fest, welche Studiendesigns jeweils geeignet sind und wie diese hierarchisiert zu bewerten sind 6-10.
Sollen nun verschiedene Fragen, wie die Wirkung, die Wirksamkeit, die Sicherheit und der Nutzen für eine Methode wissenschaftlich beurteilt werden, so sind systematische Matrixanalysen aller Studien mit der jeweiligen unterschiedlichen Hierarchisierung, bezogen auf das Studiendesign, anzufertigen und zu bewerten. Eine solche systematische Matrixanalyse der verschiedenen Fragestellungen wird synthetische Evidenz 5 genannt und steht noch weit über den Metaanalysen oder systematischen Reviews, die lediglich eine Fragestellung, wie z.B. die Wirksamkeit, anhand der Studienlage bewerten.
Leitlinien und ihre EbM Levels
Studien, die untersuchten, wie viele Empfehlungen in Leitlinien auf dem höchsten EbM Level liegen, d.h. durch wenigstens eine RCT Studie belegt sind, zeigen für die Kardiologie die höchste Prozentzahl. So sind in den Leitlinien in der Kardiologie 11% der Empfehlungen auf dem EbM Level A, hingegen 48% lediglich auf dem Level von Expertenmeinung (Expertise von Ärzten; Säule 2) 3. In der Onkologie sind ca. 6% aller in den Leitlinien gegebenen Empfehlungen auf dem EbM Level A 4. Für alle anderen Gebiete der Medizin liegt der Empfehlungslevel A in Leitlinien und damit auch Handlungsempfehlungen im entsprechenden Fachgebiet unter 5%.
Aus diesen Fakten lässt sich erkennen, wie problematisch eine Medizin ist, die nur die externe Evidenz zulässt und wie weit entfernt sie noch ist, all ihre Handlungsempfehlungen auf einem Evidenzlevel A wissenschaftlich abgesichert abgeben zu können.
Resümee
Zusammenfassend ergibt sich für die wissenschaftliche Bewertung der Medizin als Handlungswissenschaft ein 3 Säulen System einer EbM, bei der die Berücksichtigung aller 3 Säulen für eine gute EbM steht. Die einfache Pyramide der externen Evidenzhierarchie gilt als überholt, da die Fragestellung das ‚beste Studiendesign’ bestimmt und der RCT keinesfalls ein optimiertes Studiendesign für die verschiedenen Fragestellungen darstellt. Die Bewertung der EbM erfolgt daher i. S. einer zirkulären Evidenz, was bedeutet, dass jeweils der Fragestellung gemäß das Studiendesign gewählt und zu bewerten ist. Soll eine medizinische Methode bzgl. verschiedener Fragestellungen (z. B. Wirksamkeit, Sicherheit und Nutzen) bewertet werden, so stellt die sog. ‚synthetische Evidenz‘ den Goldstandard dar, bei der eine systematische Matrixanalyse der unterschiedlichen Fragestellungen hierarchisiert nach den Studiendesigns bewertet wird.
Literatur
1. Sackett D. Evidence-based medicine. Lancet. 1995;346(8983):1171
2. Sackett D. Evidence Based Medicine: How to Practice and Teach EBM. New York: Churchill Livingstone, 1997
3. Tricoci P, Allen JM, Kramer JM, Califf RM, Smith SC, Jr. Scientific evidence underlying the ACC/AHA clinical practice guidelines. JAMA. 2009;301(8):831-41
4. Poonacha TK, Go RS. Level of scientific evidence underlying recommendations arising from the National Comprehensive Cancer Network clinical practice guidelines. J Clin Oncol. 2011;29(2):186-91
5. Walach H, Falkenberg T, Fonnebo V, Lewith G, Jonas WB. Circular instead of hierarchical: methodological principles for the evaluation of complex interventions. BMC Med Res Methodol. 2006;6:29
6. Antes G. The new CONSORT statement. BMJ. 2010;340:c1432
7. Moher D, Hopewell S, Schulz KF, Montori V, Gotzsche PC, Devereaux PJ, et al. CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials. Int J Surg. 2012;10(1):28-55
8. Ross SD. The CONSORT statement. JAMA. 1996;276(23):1877; author reply
9. Schulz KF, Altman DG, Moher D, Group C. CONSORT 2010 statement: updated guidelines for reporting parallel group randomised trials. PLoS Med. 2010;7(3):e1000251
10. Schulz KF, Altman DG, Moher D, Group C. CONSORT 2010 Statement: Updated guidelines for reporting parallel group randomised trials. J Clin Epidemiol. 2010;63(8):834-40
11. Kiene H. Evidence Based Medicine - Cognition Based Medicine. Geistesgeschichtliche Hintergründe und Werdegang der Paradigmen. Der Merkurstab. 1998;51(3):123